
全国咨询电话
400-030-7667
37年专注环氧乙烷灭菌系统解决方案
点击进入新版网站
全国咨询电话
400-030-7667
服务热线:400-030-7667
配件采购:17632058661
售后服务:13810832309
投诉反馈:13699266582
邮箱:rongfeng@88.com
地址:北京市丰台区赵辛店939号
地址:河北省沧州渤海新区中捷产业园区
时间:2022-03-12浏览量:19.25 W
受新冠疫情影响,今年涌现了一批生产口罩及防护服的生产企业,此些防疫物资大都采用EO灭菌,应急审批时研究资料灭菌工艺研究可暂时不予提供,待延续时补充提交,考虑到其中一些企业涉及到转行,因此笔者整理了EO灭菌的一些基础知识,希望能给大家启示和参考。
环氧乙烷为易燃、易爆的有毒气体,与空气形成的爆炸*限为2.6%-100%,温度高于40℃EO开始聚合,所以比较难保管。为提高安全性,通常用二氧化碳或其他惰性气体作为稀释剂保管使用。
环氧乙烷在作用时,其环状结构断裂,经羟化(-CH2-CH2-OH),与菌体内蛋白质上的氨基-NH2,羧基-COOH,羟基-OH等活性基团烷基化作用,使酶代谢过程发生障碍,从而破坏菌体的新陈代谢,造成微生物的死亡。从而达到杀灭微生物的目的。
3.1 优点
●在低温下可进行灭菌,可对温度、湿度敏感的物品进行灭菌处理。
●对所有微生物都有效,包括细菌芽孢内的所有微生物均可进行有效杀灭。
●穿透能力强,在包装状态下可进行灭菌。
●对金属无腐蚀作用。
3.2 缺点(与蒸汽灭菌相比)
●灭菌时间长。
●具可燃性毒性。
●可发生化学反应生成化合物。
●所需成本较高。
解析:灭菌过程的一部分,是使环氧乙烷和/或其反应产物从医疗器械解吸附至预定水平的过程。
D值:在规定条件下,灭活90%试验微生物所需的时间或辐射剂量。
暴露时间:过程参数保持在规定允差范围内的阶段。
生物指示物(BI):对规定的灭菌过程有特定的抗力,含有活微生物的测试系统。
部分周期:与灭菌过程规定的暴露时间相比,将暴露时间减少的灭菌周期。
半周期:与灭菌过程相比,暴露时间减少50%的灭菌时间。
过程挑战装置:设计成对灭菌过程有特定的抗力,用于评估过程性能的装置。
包括产品的包装形式,产品结构、微生物数量种类、真空度、EO浓度,温度、湿度、时间等。其中浓度、温度、湿度、时间是直接因素。
浓度:解析过程中的杀菌能力不被认可,所以指示物是在灭菌出柜后取出。是在预处理前放入。
湿度:预处理及抽真空时间内完成加湿,加湿完成之后需停留一段时间,保证湿度分布均匀。
温度:相同条件下,温度越高,D值越小,每升高10℃,D值至少减少1/2。
6.1 IQ
文件确认、安全确认、 管道及仪表流程图和布局图的检查、仪表清单和仪表校准的确认、材料与物体表面的的确认、管路泄露确认、罐体泄露确认、公用设施的确认、控制系统、电器柜和接线图的确认。
注意:管道生锈是电动势的不平衡造成的,因此循环用水不用更换。进入柜室的气体均有质量要求,因为与产品接触。
6.2 OQ
通电和断电测试目的、紧急开关确认、口令的测试、 数字/模拟 输入、输出的确认、报警与连锁确认、 计算机操作界面确认、打印功能确认、罐体泄压确认、设备能力确认(门开关/真空能力/汽化器能力/罐内温度分布等)。
● OQ的核心是温湿度分布的确认,可接受标准是暴露时间内所有点的平均温度的±3℃。
注意:需要重复确认3次的项目有(均是空载):真空度及真空速率,复压及复压速率,保压泄露,汽化器汽化能力,气体导入速率,柜内温湿度分布三次(经验的三次全周期)
6.3 PQ
6.3.1MPQ:
●不同致死率方法比较
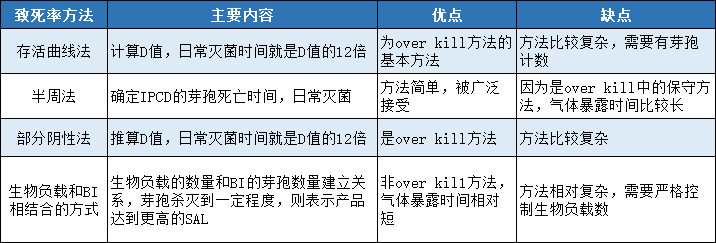
●下面以半周法为例:
以初始灭菌工艺的灭菌时间为起点,以试验生物指示物无菌为标准,在保证其他灭菌工艺参数不变的情况下,逐次将灭菌时间减半,直至找出试验生物指示物无菌的EO*短作用时间(时间临界点)。
如:初始灭菌时间为8hr
第1次灭菌循环:灭菌时间8hr,如无菌;
第2次灭菌循环:灭菌时间4hr,如无菌;
第3次灭菌循环:灭菌时间2hr,如有菌;
第4次灭菌循环:灭菌时间3hr,如无菌,则3hr为时间临界点;如有菌,则确定4 hr为时间临界点,找出临界点之后重复运行两次,运行参数为下限参数。
短周期:可多个IPCD,目的为,确定生物指示剂的适合性,产品、IPCD,EPCD的抗性比较。
BI的适合性评价:短周期运行后,BI试验的阳性应高于产品无菌试验的阳性。
6.3.2 PPQ:全周期运行三次,上限参数,产品适用性鉴定同时进行,需要进行产品性能检测及EO残留检测,另外,应评估包装的适合性,如需要,还应考虑产品的生物学评价。特别注意,日常灭菌存在灭菌失败的可能性,则确认时应进行产品连续两次灭菌适合评价。
现已知的残留有EO、ECH、EG,企业实验室的EO、ECH残留可接受水平参照16886.7或产品行业标准,如*近热卖的口罩,行业标准直接规定了EO的可接受水平。EG不用测,是因为16886.7附录1 风险评定资料表明计算出的允许限量水平高于器械中可能的残存量,另外,快速注射EG类高渗性化合物有可能会产生急性血液动力学和溶血反应,而和EO灭菌的医疗器械不会产生高渗性溶液。因此残留不用考虑EG。
通知:
为扩大生产规模,我厂(北京丰台永定消毒设备厂)于2017年在河北省沧州市投资新建20000平方米的现代化生产车间,取名:河北省荣丰消毒设备有限公司,目前已取得相关资质并已正式运行。